وقتی اکثر افراد در مورد سیالات صحبت یا فکر میکنند، در واقع منظورشان مایعات است. این برداشت کاملی نیست. در واقع، یک سیال، یک مدیوم (medium) است که ذراتی دارد که میتوانند به سادگی حرکت کرده و موقعیت نسبی خود را تغییر دهند، بدون آنکه در جرم تغییری ایجاد شود و همچنین به سادگی تحت تاثیر نیروهای اعمالشده قرار میگیرد. این یعنی سیالات شامل گازها هم میشود چون گازها همچنین جریان/دبی دارند. در واقع، ریشه کلمه سیال (fluid) از کلمه لاتین fluere آمده که معنای آن «جریان یافتن» است.
تجربیات امروزی ما شاید ما را به این نتیجه برساند که گازها قابل فشردهسازی و تراکمپذیرند، اما مایعات تراکمپذیر نیستند. مثلا بعد از فشردهسازی دسته پمپ هوای تایر ماشین و رها کردن سریع آن، یک حس بازگشتی را میتوانید احساس کنید؛ این حس، نیرویی را نشان میدهد که ناشی از فشرده و متراکم شدن هوا در حجمی کمتر است.
وقتی که نیروی فشردهساز را حذف کنید (دسته را رها کنید)، حجم دوباره به ابعاد اصلی خود بازمیگردد. به همین شکل، اگر انگشت خود را روی سوراخ کوچک یک بطری اسپری قرار دهیم، با فشردن دکمهی بالای اسپری، فورا یک نیروی مقاوم را روی انگشت خود حس میکنیم. بر اساس این مشاهده، به نظر میرسد که مایعات تراکمپذیر نیستند.
در ادامه در مورد تراکمپذیری سیالات و جامدات در یک آزمایشگاه کالیبراسیون صحبت میکنیم. درک رفتار این سیالات تحت فشار، برای کالیبراسیون موفق و دقیق، حیاتی است.
اول از همه، چند اصطلاح رایج را تعریف کنیم:
- سیال: ماده و متریالی که جریان/دبی و ویژگی روان شدن دارد و نیازمند یک نگهدارنده یا ظرف است که آن را در بر بگیرد.
- گاز: یک حالت ماده که به شکل ظرف خود در میآید و حجمی قطعی ندارد.
- مایع: یک حالت ماده که به شکل ظرف خود در میآید و حجمی قطعی دارد.
- جامد: یک حالت ماده که شکل خود را حفظ میکند و حجمی قطعی دارد.
- تراکمپذیر: قابلیت تغییر چگالی با اعمال فشار.
- چگالی: جرم در واحد حجم.
- پیوند شیمیایی: انتقال یا به اشتراکگذاری الکترونهای بیرون بین دو یا چند اتم.
- نیروی واندروالسی: نیروهای جاذب بین تمام مولکولها که توسط پلاریزاسیونهای نوسانی ذرات نزدیک ایجاد میشود و اگر مولکولها خیلی به یکدیگر نزدیک شوند، این نیرو قدرتمند میشود.
گازها در مقایسه با مایعات، رفتار متفاوتی دارند. چرا؟ برای اینکه متوجه شویم در سطح ماکرو چه اتفاقی رخ میدهد، ابتدا باید کارکرد داخلی ماده در سطح اتمی و مولوکولی را متوجه شویم. داخل هر ماده، پیوندهای شیمیایی، پلاریته (قطبش)، نیروها به علاوهی پیکربندی فیزیکی اتمها در یک مولکول، خصیصههای کلی ماده را تعیین میکنند، مواردی همچون ویسکوزیته و تراکمپذیری. این نیروها، که در مقیاسی اتمی عمل میکنند، اصلیترین عوامل موثر در خصیصههایی هستند که ما در مواد فله تجربه میکنیم.
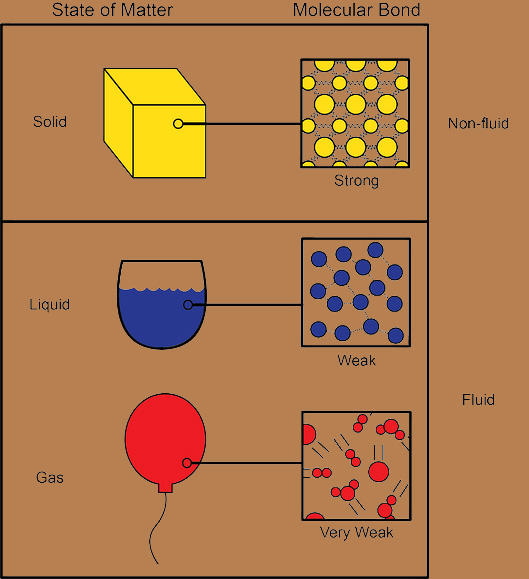
در شکل بالا، یک مقایسه بین سه حالت رایج ماده، یعنی جامد، مایع و گاز انجام شده است و انواع پیوندها بین هر حالت را نشان میدهد. در هر تصویر، ما حجم بسیار کمی از ماده را میبینیم که بزرگنمایی شده است و یک تصویرسازی سادهسازیشده از پیوندهای داخل ماده است. در ادامه، به شکلی دقیقتر به حالات مختلف ماده نمایش داده شده در تصویر پرداختیم.
جامدات
جامدات شکل خود را حفظ میکنند، دلیل این مساله پیوند شیمیایی نسبتا قدرتمند است، که به شکل فنرهایی بین هر اتم نمایش داده شده است. از طرفی، بارهای یکسان الکترونها با نزدیک شدن اتمها به یکدیگر، همدیگر را دفع میکنند. برعکس، اگر اتمها از هم دور شوند، توسط پیوند به سمت یکدیگر کشیده میشوند.
به دلیل قدرت پیوند، فاصله بین اتمها خیلی کم است، اما این پیوند میتواند آنها را بسیار محکم در کنار هم نگه دارد، به دلیل نیروهای دافع. پس وقتی که یک نیرویی از تمام جهات به این مکعب ماده اعمال شود، مقاومت در برابر فشردهسازی بین هر اتم به شدت بالاست، در نتیجه شاهد فشردهسازی و تراکمپذیری بسیار کمی در جامد خواهیم بود.
سیال مایع
در سمت دیگر، در مایعات، فاصله بین مولکولها بیشتر است در نتیجه میتوانند حرکت نسبی بیشتری داشته باشند. از طرفی، پیوندهای بین مولکولی مثل جامدات قدرتمند نیستند. به طور مثال آب یک مولکول قطبی است و جاذبه دوقطبی-دوقطبی از خود نشان میدهد، همانطور که با خطوط نقطهچین در شکل ۱ نمایش داده شده است.
اتم اکسیژن تا حدی منفی است و دو اتم هیدروژن تا حدی مثبت هستند. از آنجایی که بارهای دوقطبی ضعیفتر از پیوندهای معمول هستند، نیروهای واندروالسی بین مولکولها ضعیف است و پیوسته نیست. ممکن است هزاران بار در ثانیه، هر یک بشکند و دوباره تشکیل شود. به همین دلیل است که آب جاری و روان است و همچنان به شکل مایع باقی میماند. نیروهای بین مولکولی ضعیفتر و فاصله بین مولکولی بیشتر، دلیل این است که مایعات را میتوان بیشتر از جامدات فشرده و متراکم کرد.
گازها
برای گازهایی مثل نیتروژن یا هوا، هیچ پیوندی بین مولکولها در دما و فشار نرمال وجود ندارد. هر مولکول با نرخ بالایی از سرعت در جهات مختلف در حرکت است. وقتی دو مولکول گاز به یکدیگر برخورد میکنند، با کشسانی یا الاستیسیتهی کامل، همدیگر را میرانند.
هیچ اتلافی در این برخوردها وجود ندارد. فاصله بین مولکولی به حدی بزرگ است که نیروهای بین مولکولی قابل توجه نیستند. در دمای اتاق و فشار استاندارد، فاصله متوسط بین مولکولهای گاز ده برابر قطر خود مولکولهاست. بنابراین وقتی یک نیروی خارجی به مولکولهای گاز وارد شود، به زور در کنار یکدیگر جمع شده و بهم نزدیکتر میشود و در نتیجه گازها به شدت تراکمپذیر هستند.
نرخ تراکمپذیری سیال
حال ما میدانیم که در سطح مولکولی، گازها و مایعات، تراکمپذیری بیشتری از جامدات دارند. تراکمپذیری سیال فشار رایج استفاده شده در آزمایشگاه کالیبراسیون چطور؟
میزان نسبی تراکمپذیری ماده با نیروی اعمالشده، درک ما از سِفتی را تعیین میکند. وقتی که یک متریال از تمام جهات فشرده شود، به نسبت فشار اعمال شده، منقبض و جمع میشود. به ثابت تناسب، مدول حجمی (ضریب کشسانی حجمی) میگویند.
Β = – V * (∂P ⁄ ∂V)
که B برابر است با مدول حجمی
و V حجم ابتدایی است
و ∂P/∂V برابر است با تغییر در فشار، نسبت به تغییر در حجم
دقت کنید که افزایش در فشار، باعث کاهش حجم میشود، که اشاره به این دارد که چگالی ماده در حال افزایش است. اگر نیروی یکسان به حجم برابری از جامد، مایع یا گاز اعمال شود، مقادیر نسبی کاهش حجمی واضح است.
مدول حجمی ایزوترمال (همدما) هر حالت ماده را میتوان مقایسه کرد تا نرخ مرتبه بزرگی را به دست آورد. در ادامه، مدول حجمی برای برخی مواد رایج در هر حالت آمده است:
فولاد ضد زنگ:
-۲۳,۶۰۰,۰۰۰ lbf./sq. in.
آب:
-۳۱۰,۰۰۰ lbf./sq. in.
هوا در STP:
-۱۴٫۷ lbf./sq. in.
نرخ مقایسهای مواد اینجا بیان شده است:
فولاد ضد زنگ : آب : هوا
۱,۶۰۰,۰۰۰ : ۲۱,۰۰۰ : ۱
این اعداد، سِفتی نسبی مواد هستند. هر چقدر عدد بزرگتر باشد، ماده تراکمپذیری کمتری دارد. به طور مثال، نسبت آب به هوا ۲۱,۰۰۰:۱ است، بنابراین ما تراکمپذیری آب را در پمپ اسپری (با پوشاندن حفره خروجی آن) درک و احساس نمیکنیم. میزان فشردگی در این مثال به حدی کم است که ما با حواس خود نمیتوانیم آن را احساس کنیم.
باید دقت کنید که مدول حجمی به فشار و دما وابسته است. برای آب، با افزایش فشار، مدول حجمی افزایش پیدا میکند. با افزایش دمای سیال از ۰°C در فشار ثابت، مدول حجمی افزایش پیدا میکند و در ۳۳۰,۰۰۰lbf./sq.in. در ۴۵°C به اوج خود میرسد و سپس کاهش پیدا میکند.
این مساله به زنجیرهی پیچیدهای از رویدادها در محیط کالیبراسیون منجر میشود. با افزایش فشار سیستم، سیال فشرده میشود و تمام اجزای آن منبسط میشود (کنترلر فشار، لولهها، اتصالات، محفظه فشار و غیره).
قطعاتی که سیال پیرامون آنهاست فشرده میشوند و مدول حجمی مدیوم با فشار و دما تغییر میکند. در سیستمهای فشار بالا، در نظر گرفتن جبران مدول حجمی نسبی، درایو شده توسط پیوند مواد، همراه با مهندسی خوب، به سیستمهای کالیبراسیون دقیق و قابل اطمینان منتهی میشود.
نتیجهگیری
تراکمپذیری سیالات نقشی حیاتی در طراحی سیستم فرآیند در بخش صنعتی و همچنین حفظ بهرهوری در زیرساخت یک آزمایشگاه کالیبراسیون دارند.
انتخاب کالیبراتور مناسب و همزمان بهینهسازی سیستم برای جبران تراکمپذیری اجزای سیستم و سیال مورد استفاده، به نتایج کالیبراسیون دقیقتر منجر میشود.
تراکمپذیری با سیالات مایع مختلف، متفاوت است، به دلیل تفاوت در مدول حجمی، ویسکوزیته،